

-
首页新闻
按发稿时间排序
首页 > 新药介绍
2016-02-18
国家食品药品监督管理总局批准上市药品公告(2016年第37号)
2016年1月,批准国产化学药品上市申请2件(品种目录见附件)。
特此公告。
附件:2016年1月份已批准药品上市品种目录
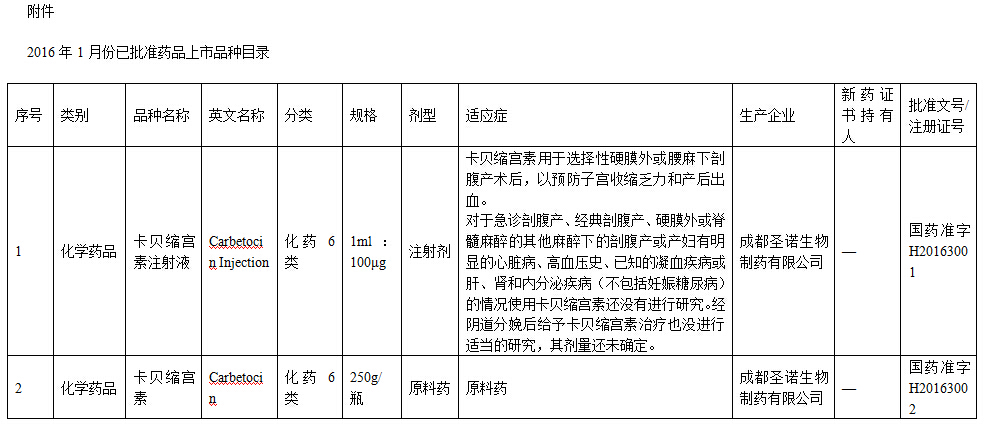
特此公告。
附件:2016年1月份已批准药品上市品种目录
食品药品监管总局
2016年2月4日

2015-10-10
近日,绿叶制药集团宣布,美国食品药品监督管理局(FDA)确认公司研发的利培酮微球注射剂(LY03004)不需再进行任何临床试验,可在美提交新药申请(NDA)。这标志着绿叶制药,同时也是中国首个自主研发的微球制剂产品将在不远的未来进入美国市场。有分析人士认为,这个时间或许是1年之内。
创新点在哪里?
据了解,利培酮是时下最有效的精神分裂症药物之一,它是强有力的D2拮抗剂,可以改善精神分裂症的阳性症状,且对治疗躁狂症有奇效,而它引起的运动功能抑制,以及强直性昏厥都要比经典的抗精神病药少。
目前利培酮长效注射(Risperdal Consta)是市场上的主力,2013年利培酮全球市场为13.18亿美元。而RisperdalConsta首次注射后无法立刻达到血药浓度,必须口服三周药物,其结果造成精神分裂症病人用药依从性不佳。
而绿叶制药集团的利培酮微球注射剂是长效缓控释微球技术,患者接受首次注射后三周毋须再服用口服制剂;比市场药品更快达到稳态血药浓度。有效解决了患者用药依从性不佳的问题。
美国汉佛莱伊医药顾问有限公司(HPC)BD负责人赵东对赛柏蓝表示,绿叶制药的利培酮微球注射剂新药申请是改变剂型或者适应症的创新药申请(美国FDA注册归为505(b)(2)),并不是全新化合物的创新药申请,所以安全性不会有问题,相对容易获批。
赵东认为,这是中国药企实现国际化的一个必要途径,完成了国内医药企业的再一次突破,这比单纯的仿制药还是要难得多,这个突破背后不仅意味着中国的研发水平,国际注册水平,国际专利意识,都到达了一个层次,还意味着对国际药审游戏的把握越来越熟悉。
对于绿叶制药集团来说,这为其以后申报产品奠定了一个好的基础,因为谁都有先入为主的观点,FDA也一样,对于一个完全没有报过新药的国家,他的怀疑和挑剔自然多得多。比如印度频频被查出数据造假,FDA对于印度公司的数据就会存有疑问。
这对国内医药企业走向海外的信心有很大的提振,尤其是在目前医药利润不断下降的环境下,走向国际不仅仅是一种必然选择,也告诉国内企业,这不是一条绝路,而是更大的市场和更多的利润。
走出国门新策略
目前国内药企最为纠结是到底做创新还是做仿制药,绿叶在产品开发策略上给国内药企提供了非常大的启迪:从改变剂型入手。实际上,这也是武田、Hospira这样的公司另辟出来的一条蹊径——从给药系统DDS入手进行创新,收获“短平快”的奇效。
从口服的缓控释制剂,到靶向给药剂、定位给药或是经皮给药剂型等,DDS对于专利过期的许多重磅炸弹式药物,通过采取更优的药物释放技术,并利用药物释放技术自身的专利来延伸该药物的专利保护,是大公司通常采用的稳固自己关键产品市场的常用策略。
这个市场的竞争技术门槛较高,但是临床风险较低,而收益则相对仿制药丰厚得多。在这条路径上获得成功的案例比比皆是:如武田89年上市的亮丙瑞林缓释微球成就了武田的国际化梦想,年销售额仍保持在10亿美元以上的高位,阿斯利康的戈舍瑞林长效缓释植入体制剂上市已近30年,仍是重磅及的产品,尽管专利早已到期,但高技术壁垒导致仿制品开发很困难,类似的案例还有诺华的奥曲肽缓释微球等很多的产品。
创新点在哪里?
据了解,利培酮是时下最有效的精神分裂症药物之一,它是强有力的D2拮抗剂,可以改善精神分裂症的阳性症状,且对治疗躁狂症有奇效,而它引起的运动功能抑制,以及强直性昏厥都要比经典的抗精神病药少。
目前利培酮长效注射(Risperdal Consta)是市场上的主力,2013年利培酮全球市场为13.18亿美元。而RisperdalConsta首次注射后无法立刻达到血药浓度,必须口服三周药物,其结果造成精神分裂症病人用药依从性不佳。
而绿叶制药集团的利培酮微球注射剂是长效缓控释微球技术,患者接受首次注射后三周毋须再服用口服制剂;比市场药品更快达到稳态血药浓度。有效解决了患者用药依从性不佳的问题。
美国汉佛莱伊医药顾问有限公司(HPC)BD负责人赵东对赛柏蓝表示,绿叶制药的利培酮微球注射剂新药申请是改变剂型或者适应症的创新药申请(美国FDA注册归为505(b)(2)),并不是全新化合物的创新药申请,所以安全性不会有问题,相对容易获批。
赵东认为,这是中国药企实现国际化的一个必要途径,完成了国内医药企业的再一次突破,这比单纯的仿制药还是要难得多,这个突破背后不仅意味着中国的研发水平,国际注册水平,国际专利意识,都到达了一个层次,还意味着对国际药审游戏的把握越来越熟悉。
对于绿叶制药集团来说,这为其以后申报产品奠定了一个好的基础,因为谁都有先入为主的观点,FDA也一样,对于一个完全没有报过新药的国家,他的怀疑和挑剔自然多得多。比如印度频频被查出数据造假,FDA对于印度公司的数据就会存有疑问。
这对国内医药企业走向海外的信心有很大的提振,尤其是在目前医药利润不断下降的环境下,走向国际不仅仅是一种必然选择,也告诉国内企业,这不是一条绝路,而是更大的市场和更多的利润。
走出国门新策略
目前国内药企最为纠结是到底做创新还是做仿制药,绿叶在产品开发策略上给国内药企提供了非常大的启迪:从改变剂型入手。实际上,这也是武田、Hospira这样的公司另辟出来的一条蹊径——从给药系统DDS入手进行创新,收获“短平快”的奇效。
从口服的缓控释制剂,到靶向给药剂、定位给药或是经皮给药剂型等,DDS对于专利过期的许多重磅炸弹式药物,通过采取更优的药物释放技术,并利用药物释放技术自身的专利来延伸该药物的专利保护,是大公司通常采用的稳固自己关键产品市场的常用策略。
这个市场的竞争技术门槛较高,但是临床风险较低,而收益则相对仿制药丰厚得多。在这条路径上获得成功的案例比比皆是:如武田89年上市的亮丙瑞林缓释微球成就了武田的国际化梦想,年销售额仍保持在10亿美元以上的高位,阿斯利康的戈舍瑞林长效缓释植入体制剂上市已近30年,仍是重磅及的产品,尽管专利早已到期,但高技术壁垒导致仿制品开发很困难,类似的案例还有诺华的奥曲肽缓释微球等很多的产品。
2015-06-29
中国自主知识产权的原创抗癌新药西达本胺成功上市,打破了抗癌药物被外国药企一统天下的格局。
2015年5月22日,一则新闻引起全社会的关注,中国自主知识产权的原创抗癌新药西达本胺获准全球上市。这不仅意味着我国有了自己原创的抗癌新药,同时,对很多中晚期癌症患者来说,这就是一个救命的药。
这就是我国自主研发的抗癌新药-西达本胺,研发单位是深圳一家名为微芯生物公司的企业,总裁鲁先平是中国协和医科大学分子生物学与肿瘤生物学博士,美国加州大学药理系博士后。
2001年,从美国回来的鲁先平和另外5名从国外回来的博士,在深圳创立了微芯生物科技公司,研发的目标就是找到一种抗癌的药物。鲁先平和他的团队经过十年研发,数十万次的实验,终于研制出这种专门抑制肿瘤细胞扩散转移的原创化学新药—西达本胺,这个药物最大的功能是,用来对抗极易复发的外周T细胞淋巴瘤。
微芯生物公司总裁鲁先平:这个代价是十年左右的研发时间,那么将近10亿美元以上的研发成本。
T细胞淋巴瘤是恶性程度非常的高的肿瘤,这种病在我国的初发和复发患者每年约为5万人,五年存活率仅为25%。那么抑制肿瘤细胞扩散转移的西达本胺与其他的抗癌药品有哪些不同呢?西达本胺的抗癌原理又是什么呢?鲁先平告诉记者,数十万次的实验中,他们发现了一种高分子物质——酶,几乎所有细胞活动都需要酶的参与。西达本胺通过精确控制与肿瘤细胞活动密切相关的4种酶,就可以激活人体内抗肿瘤细胞的免疫功能,控制肿瘤复发和转移。
中国自主知识产权的原创抗癌新药西达本胺在我国成功上市,打破了抗癌药物被外国药企一统天下的格局。中国成功自主研发抗癌药的消息一经发布,就吸引了全世界的目光,时代周刊、福布斯等杂志用大量篇幅进行报道,引起了轰动。西达本胺也成为我国首个授权美国等发达国家的原创新药,14年前,中国有世界上数量最多的制药企业,达7000多家。中国药企的制剂生产能力全球第一,原料药生产能力全球第二,但是盈利水平非常低。究其原因,就在于更多的是模仿,缺乏创新。
采访时央视财经《经济半小时》记者了解到,包括微芯公司在内,全球仅3家企业在生产同类药物,其中两家在美国,每月治疗费用分别为28万元人民币和14万元人民币。而相比之下,西达本胺每月费用为2万多元人民币。如今由微芯公司研制的另一种专门针对乳腺癌的药物已经进入临床三期,一旦审核通过,那么这款抑制乳腺癌耐药性和转移复发的新药将攻克这一世界性难题,续写他原创新药的传奇。
就在鲁先平为新药上市做准备的同时,另一家抗癌药物生产企业贝达药业董事长丁列明,也在为他第二代治疗肺癌药物进行临床观察,处理完手头工作,他便赶到浙江省肿瘤医院了解情况。
躺在病床上的这位患者是在2012年被确诊为肺癌晚期,当时癌细胞已经转移到头部,病情较为严重,生命危在旦夕。她所患的肺癌被称为“静悄悄的杀手”,早期、中期发病很难发现,一旦发现便已到晚期,所有的医疗手段均无明显效果。
上世纪五六十年代,化疗药出现。“宁可错杀三千,不能放过一个”,化疗药在杀死肿瘤细胞的同时,良性细胞也被大量杀死,副作用极大。
贝达药业董事长丁列明:所以理想的治疗药物,当然能够把肿瘤细胞分开,我只能杀肿瘤细胞,对正常细胞没影响,这个就是所谓我们要新开发的一代药物,就是靶向治疗。
与鲁先平一样,丁列明也是在美国攻读完博士学位后,拉着几个海归踏上了回国研发原创新药的征程。在美国读书期间,丁列明同样发现我国针对恶性肿瘤自主研发的新药寥寥无几,绝大部分是仿制药,抗癌药物基本被国外垄断,药价十分昂贵。
丁列明:要解决老百姓的用药需求问题,光靠仿制这条路也是不够了,必须有自主研发的药,来打破他们垄断,把价格降下来,用我们自己的东西,自己的产品,让更多的百姓,让我们的病人用得起,用得上。
2011年丁列明和他的团队用10年时间,研发成功世界第三个、中国第一例治疗肺癌的小分子靶向抗癌药—埃克替尼,从而结束了我国小分子靶向抗癌药完全依赖进口的历史。
丁列明:我们不可能老是依赖进口,所以我们这个产业永远都会在别人的后面。
2011年丁列明和他的团队用10年时间,研发成功世界第三个、中国第一例治疗肺癌的小分子靶向抗癌药—埃克替尼
迄今为止全国已有近6万名晚期肺癌病人服用凯美纳,其中6000多名晚期肺癌病人服用凯美纳,疾病控制率79%,治疗有效率34%,不良反应明显低于进口药。截至2014年底,凯美纳累计实现销售超15亿元,税收超4亿。
丁列明:无论从市场的角度,无论从我们研发的能力的角度,那么应该说中国已经越来越被国际的同行们所认可,那么应该我们也看到我们中国的自主研发的新药的能力也在加强,项目越来越多。
半小时观察:
据卫计委调查表明,目前我国每年新发癌症病例约为312万例,平均每天确诊8550人,每分钟就有6人被诊断为癌症,平均10秒钟就有一人确诊,每年因癌症死亡病例达270万例。攻克癌症是世界性的的难题,全球的科学家们正在为攻克癌症不断地做出努力。每年的2月4日是世界癌症日,今年的主题是癌症防控目标,实现并不遥远。癌症防治是一项很艰巨的任务,为了进一步加强对整个防控工作的指导,国家卫生计生委正在研究制定2016-2025年癌症防治中长期防治规划,对于那些符合成本效益的早期癌症筛查、干预和适宜技术,我们在进行科学评估的基础上,要加大整个推广力度,使更多的百姓能够从中受益。
2015年5月22日,一则新闻引起全社会的关注,中国自主知识产权的原创抗癌新药西达本胺获准全球上市。这不仅意味着我国有了自己原创的抗癌新药,同时,对很多中晚期癌症患者来说,这就是一个救命的药。
这就是我国自主研发的抗癌新药-西达本胺,研发单位是深圳一家名为微芯生物公司的企业,总裁鲁先平是中国协和医科大学分子生物学与肿瘤生物学博士,美国加州大学药理系博士后。
2001年,从美国回来的鲁先平和另外5名从国外回来的博士,在深圳创立了微芯生物科技公司,研发的目标就是找到一种抗癌的药物。鲁先平和他的团队经过十年研发,数十万次的实验,终于研制出这种专门抑制肿瘤细胞扩散转移的原创化学新药—西达本胺,这个药物最大的功能是,用来对抗极易复发的外周T细胞淋巴瘤。
微芯生物公司总裁鲁先平:这个代价是十年左右的研发时间,那么将近10亿美元以上的研发成本。
T细胞淋巴瘤是恶性程度非常的高的肿瘤,这种病在我国的初发和复发患者每年约为5万人,五年存活率仅为25%。那么抑制肿瘤细胞扩散转移的西达本胺与其他的抗癌药品有哪些不同呢?西达本胺的抗癌原理又是什么呢?鲁先平告诉记者,数十万次的实验中,他们发现了一种高分子物质——酶,几乎所有细胞活动都需要酶的参与。西达本胺通过精确控制与肿瘤细胞活动密切相关的4种酶,就可以激活人体内抗肿瘤细胞的免疫功能,控制肿瘤复发和转移。
中国自主知识产权的原创抗癌新药西达本胺在我国成功上市,打破了抗癌药物被外国药企一统天下的格局。中国成功自主研发抗癌药的消息一经发布,就吸引了全世界的目光,时代周刊、福布斯等杂志用大量篇幅进行报道,引起了轰动。西达本胺也成为我国首个授权美国等发达国家的原创新药,14年前,中国有世界上数量最多的制药企业,达7000多家。中国药企的制剂生产能力全球第一,原料药生产能力全球第二,但是盈利水平非常低。究其原因,就在于更多的是模仿,缺乏创新。
采访时央视财经《经济半小时》记者了解到,包括微芯公司在内,全球仅3家企业在生产同类药物,其中两家在美国,每月治疗费用分别为28万元人民币和14万元人民币。而相比之下,西达本胺每月费用为2万多元人民币。如今由微芯公司研制的另一种专门针对乳腺癌的药物已经进入临床三期,一旦审核通过,那么这款抑制乳腺癌耐药性和转移复发的新药将攻克这一世界性难题,续写他原创新药的传奇。
就在鲁先平为新药上市做准备的同时,另一家抗癌药物生产企业贝达药业董事长丁列明,也在为他第二代治疗肺癌药物进行临床观察,处理完手头工作,他便赶到浙江省肿瘤医院了解情况。
躺在病床上的这位患者是在2012年被确诊为肺癌晚期,当时癌细胞已经转移到头部,病情较为严重,生命危在旦夕。她所患的肺癌被称为“静悄悄的杀手”,早期、中期发病很难发现,一旦发现便已到晚期,所有的医疗手段均无明显效果。
上世纪五六十年代,化疗药出现。“宁可错杀三千,不能放过一个”,化疗药在杀死肿瘤细胞的同时,良性细胞也被大量杀死,副作用极大。
贝达药业董事长丁列明:所以理想的治疗药物,当然能够把肿瘤细胞分开,我只能杀肿瘤细胞,对正常细胞没影响,这个就是所谓我们要新开发的一代药物,就是靶向治疗。
与鲁先平一样,丁列明也是在美国攻读完博士学位后,拉着几个海归踏上了回国研发原创新药的征程。在美国读书期间,丁列明同样发现我国针对恶性肿瘤自主研发的新药寥寥无几,绝大部分是仿制药,抗癌药物基本被国外垄断,药价十分昂贵。
丁列明:要解决老百姓的用药需求问题,光靠仿制这条路也是不够了,必须有自主研发的药,来打破他们垄断,把价格降下来,用我们自己的东西,自己的产品,让更多的百姓,让我们的病人用得起,用得上。
2011年丁列明和他的团队用10年时间,研发成功世界第三个、中国第一例治疗肺癌的小分子靶向抗癌药—埃克替尼,从而结束了我国小分子靶向抗癌药完全依赖进口的历史。
丁列明:我们不可能老是依赖进口,所以我们这个产业永远都会在别人的后面。
2011年丁列明和他的团队用10年时间,研发成功世界第三个、中国第一例治疗肺癌的小分子靶向抗癌药—埃克替尼
迄今为止全国已有近6万名晚期肺癌病人服用凯美纳,其中6000多名晚期肺癌病人服用凯美纳,疾病控制率79%,治疗有效率34%,不良反应明显低于进口药。截至2014年底,凯美纳累计实现销售超15亿元,税收超4亿。
丁列明:无论从市场的角度,无论从我们研发的能力的角度,那么应该说中国已经越来越被国际的同行们所认可,那么应该我们也看到我们中国的自主研发的新药的能力也在加强,项目越来越多。
半小时观察:
据卫计委调查表明,目前我国每年新发癌症病例约为312万例,平均每天确诊8550人,每分钟就有6人被诊断为癌症,平均10秒钟就有一人确诊,每年因癌症死亡病例达270万例。攻克癌症是世界性的的难题,全球的科学家们正在为攻克癌症不断地做出努力。每年的2月4日是世界癌症日,今年的主题是癌症防控目标,实现并不遥远。癌症防治是一项很艰巨的任务,为了进一步加强对整个防控工作的指导,国家卫生计生委正在研究制定2016-2025年癌症防治中长期防治规划,对于那些符合成本效益的早期癌症筛查、干预和适宜技术,我们在进行科学评估的基础上,要加大整个推广力度,使更多的百姓能够从中受益。
2015-04-08
日本制药巨头武田(Takeda)近日宣布,糖尿病新药Zafatek(trelagliptin succinate,曲格列汀琥珀酸盐)获日本卫生劳动福利部(MHLW)批准,用于2型糖尿病的治疗。此次批准,标志着Zafatek成为全球上市的首个每周口服一次的降糖药,同时也代表着武田在糖尿病市场投下的一枚重磅炸弹!
Zafatek由武田和Furiex研发,该药是一种超长效二肽基肽酶IV(DPP-4)抑制剂,每周口服一次,而市场上同类DPP-4抑制剂需要每天口服一次,Zafatek的用药优势无疑将为糖尿病患者提供了更为方便的治疗选择,有望大幅改善患者的便利性和依从性。
目前,美国制药巨头默沙东(Merck)也正在开发一款超长效DPP-4抑制剂omarigliptin,该公司于去年底向日本提交了全球首个监管申请。在临床试验中,omarigliptin疗效媲美自身年销40亿美元的每日一次DPP-4抑制剂Januvia(捷诺维,sitagliptin,西他列汀)。业界认为,omarigliptin将成为默沙东捍卫其口服降糖药市场霸主地位的重要筹码。
据了解,DPP-4抑制剂是首类可通过提高机体自身能力控制血糖水平的新型2型糖尿病药物,可用作单药,也可与其它口服降糖药联用,其作用机制独特,具有不产生低血糖、不引起体重增加,以及副作用小等独特优势,同时引起胃肠道不良反应的发生率亦很低。
Zafatek由武田和Furiex研发,该药是一种超长效二肽基肽酶IV(DPP-4)抑制剂,每周口服一次,而市场上同类DPP-4抑制剂需要每天口服一次,Zafatek的用药优势无疑将为糖尿病患者提供了更为方便的治疗选择,有望大幅改善患者的便利性和依从性。
目前,美国制药巨头默沙东(Merck)也正在开发一款超长效DPP-4抑制剂omarigliptin,该公司于去年底向日本提交了全球首个监管申请。在临床试验中,omarigliptin疗效媲美自身年销40亿美元的每日一次DPP-4抑制剂Januvia(捷诺维,sitagliptin,西他列汀)。业界认为,omarigliptin将成为默沙东捍卫其口服降糖药市场霸主地位的重要筹码。
据了解,DPP-4抑制剂是首类可通过提高机体自身能力控制血糖水平的新型2型糖尿病药物,可用作单药,也可与其它口服降糖药联用,其作用机制独特,具有不产生低血糖、不引起体重增加,以及副作用小等独特优势,同时引起胃肠道不良反应的发生率亦很低。
2015-01-19
我国首个完全自主研发的抗癌新药艾坦(阿帕替尼)2014年12月13日上市,这是目前晚期胃癌靶向药物中唯一的口服制剂,可显着延长晚期胃癌患者的生存时间。同时,艾坦也是全球首个被证实在晚期胃癌标准化疗失败后,安全有效的小分子抗血管生成靶向药物。该药的研发成功,标志着我国制药企业已经走上了由“仿制”到“创新”的战略性规模化发展道路,有助于推动我国从“医药大国”向“医药强国”转型。
据了解,全球四成以上胃癌患者在中国,发病率远远高于欧美等国家。由于该病早期症状不典型,且胃镜常规检查未普及,因而我国60%~80%的胃癌患者就诊时已到晚期。加上现有治疗手段获益有限,预后差,晚期胃癌患者5年生存率多不超过20%。
艾坦是国家“十一五”“十二五”重大新药创制专项之一,由江苏恒瑞医药股份有限公司研发生产。解放军南京八一医院副院长秦叔逵和复旦大学附属肿瘤医院内科主任李进教授共同牵头、38家中心参与的艾坦治疗晚期胃癌III期临床实验,进一步证实了该药治疗晚期胃癌病人的有效性和安全性。在III期研究中的31号晚期胃癌患者,已服用该药存活44个月。同时,艾坦作为口服药物,方便应用,有助于提高患者依从性,且大大减低治疗费用。
国家卫生计生委科技教育司司长秦怀金表示,现在中国企业已经拥有一批研发能力强、研究方向明确的专业化新药研发人才,民族制药企业正走在科研创新的道路上并取得了一定成果

2014-04-30
核心提示:复星医药日前宣布,经过近一年的谈判,公司与全球结核病药物研发联盟(TBAlliance)达成一致,获得该联盟开发的新型抗肺结核药物PaMZ在中国的开发、注册、生产、销售权利的独家授权。比尔和梅琳达?盖茨基金会将拨付专项资金继续支持该药物的全球性开发和临床研究。 复星医药日前宣布,经过近一年的谈判,公司与全球结核病药物研发联盟(TBAlliance)达成一致,获得该联盟开发的新型抗肺结核药物PaMZ在中国的开发、注册、生产、销售权利的独家授权。比尔和梅琳达?盖茨基金会将拨付专项资金继续支持该药物的全球性开发和临床研究。
全球结核病药物研发联盟是一家非盈利的国际药物研发组织,主要研发抗结核药物,此次达成合作的药物PaMZ是一种新型抗肺结核药物疗法,它可以在更短的时间内以更简单、安全、廉价的疗法治疗药物敏感肺结核(DS-TB)及耐多药结核病(MDR-TB)。该疗法已完成二期临床,并准备进入全球第三期临床试验。
根据该协议,复星医药旗下的复星医药产业公司和沈阳红旗制药有限公司将具体承担该药物在中国的开发、注册、生产、销售。按照该协议,作为新宣布的STAND(通过改进新药缩短结核治疗)试点第三期的一部分,复星医药方面会支持其在中国的研发试点,并开展为获得PaMZ监管批准所需的一切相关研究。如果该疗法获得成功,复星医药将在授权地区把PaMZ投入商业化运营。复星医药同时承诺,确保该疗法遵循价格低廉和方便易得的原则,可为大众使用。
全球结核病药物研发联盟是一家非盈利的国际药物研发组织,主要研发抗结核药物,此次达成合作的药物PaMZ是一种新型抗肺结核药物疗法,它可以在更短的时间内以更简单、安全、廉价的疗法治疗药物敏感肺结核(DS-TB)及耐多药结核病(MDR-TB)。该疗法已完成二期临床,并准备进入全球第三期临床试验。
根据该协议,复星医药旗下的复星医药产业公司和沈阳红旗制药有限公司将具体承担该药物在中国的开发、注册、生产、销售。按照该协议,作为新宣布的STAND(通过改进新药缩短结核治疗)试点第三期的一部分,复星医药方面会支持其在中国的研发试点,并开展为获得PaMZ监管批准所需的一切相关研究。如果该疗法获得成功,复星医药将在授权地区把PaMZ投入商业化运营。复星医药同时承诺,确保该疗法遵循价格低廉和方便易得的原则,可为大众使用。
2014-02-28
日前,包括一系列呼吸系统药物在内的10款新药获得欧洲药品管理局(EMA)专家顾问的上市许可推荐,从而使得这些药物朝着进入欧洲市场迈进了一大步。
人用医药产品委员会(CHMP)已对6款呼吸系统治疗药物发布了上市许可推荐。这6款呼吸系统药物中有4款将用于成人慢性阻塞性肺疾病(COPD)患者治疗,有葛兰素史克的Anoro(Umeclidinium bromide/维兰特罗)、Laventair(Umeclidinium bromide/ Vilanterola)及Incruse(Umeclidinium bromide),诺华的Ulunar Breezhaler(茚达特罗/格隆溴铵)。另外两款药物旨在用于哮喘及COPD治疗,有梯瓦制药的DuoResp Spiromax(布地奈德/福莫特罗)和BiResp Spiromax(布地奈德/福莫特罗)。
此外,辉瑞的普瑞巴林被推荐用于治疗神经性疼痛、癫痫和焦虑症,BioMarin的孤儿药Vimizim被推荐用于罕见遗传性疾病粘多糖贮积症IVA型,强生的Vokanamet(坎格列净/二甲双胍)被推荐用于2型糖尿病治疗。
CHMP还为Pierre Fabre公司的Hemangiol发布了一项儿科用药上市许可(PUMA) 推荐,用于婴幼儿血管瘤增生治疗,这是血管在皮肤或内脏异常生长的一种疾病。这也是自PUMA计划于2007年实施以来给予的第二次积极推荐意见,根据这一计划,药物可专门获批用于儿童患者。
人用医药产品委员会(CHMP)已对6款呼吸系统治疗药物发布了上市许可推荐。这6款呼吸系统药物中有4款将用于成人慢性阻塞性肺疾病(COPD)患者治疗,有葛兰素史克的Anoro(Umeclidinium bromide/维兰特罗)、Laventair(Umeclidinium bromide/ Vilanterola)及Incruse(Umeclidinium bromide),诺华的Ulunar Breezhaler(茚达特罗/格隆溴铵)。另外两款药物旨在用于哮喘及COPD治疗,有梯瓦制药的DuoResp Spiromax(布地奈德/福莫特罗)和BiResp Spiromax(布地奈德/福莫特罗)。
此外,辉瑞的普瑞巴林被推荐用于治疗神经性疼痛、癫痫和焦虑症,BioMarin的孤儿药Vimizim被推荐用于罕见遗传性疾病粘多糖贮积症IVA型,强生的Vokanamet(坎格列净/二甲双胍)被推荐用于2型糖尿病治疗。
CHMP还为Pierre Fabre公司的Hemangiol发布了一项儿科用药上市许可(PUMA) 推荐,用于婴幼儿血管瘤增生治疗,这是血管在皮肤或内脏异常生长的一种疾病。这也是自PUMA计划于2007年实施以来给予的第二次积极推荐意见,根据这一计划,药物可专门获批用于儿童患者。
2013-10-11
2013年10月9日世界卫生组织(WHO)通报国家食品药品监督管理总局,中国生物技术股份有限公司下属的成都生物制品研究所有限责任公司生产的乙型脑炎减毒活疫苗通过了WHO的疫苗预认证,成为中国通过WHO预认证的首个疫苗产品。这标志着在经历了不懈的努力后,中国疫苗产品的监管、研制和生产获得了国际的广泛认可,产品得以进入国际市场。
国产乙型脑炎疫苗通过WHO的疫苗预认证后,联合国采购机构即可将此产品列入采购目录。更重要的是,因中国产疫苗产品的质量、产能和价格优势,将为发展中国家儿童免于乙脑危害提供有力支撑。对此,世卫组织总干事陈冯富珍博士表示“中国疫苗生产潜力巨大,我们希望能够看到越来越多的中国疫苗产品通过世界卫生组织的预认证,全世界都会因此而受益”。
2011年3月WHO宣布我国国家药品监管机构通过了世界卫生组织疫苗监管体系的评估,从此,中国的疫苗生产企业具备了申请世界卫生组织疫苗预认证的资格,打开了中国疫苗产品进入国际市场的大门。近年来,随着食品药品监管部门通过推行新修订药品GMP(2010版)等多项措施,不断提高生产标准和监管水平,我国药品生产企业整体水平迅速提高,为中国疫苗产品获得国际认可创造了条件。
中国药品生产企业为全世界提供安全有效的疫苗产品是中国履行国际责任和义务的体现。国家食品药品监督管理总局将继续提高监管能力、加强各项监管措施,鼓励、支持和引导企业研制、生产向国际标准看齐,通过WHO预认证这个平台,努力让更多符合国际标准的高质量药品进入国际市场,并以此为契机,促进我国药品产业的全面升级和药品质量水平的全面提升。
乙型脑炎是一种由蚊子叮咬传播的疾病,会导致大脑炎症,其地域性季节性的流行属于世界性重大公共卫生问题。由于目前没有针对乙脑的专门治疗手段,注射疫苗是一项有效预防措施。
国产乙型脑炎疫苗通过WHO的疫苗预认证后,联合国采购机构即可将此产品列入采购目录。更重要的是,因中国产疫苗产品的质量、产能和价格优势,将为发展中国家儿童免于乙脑危害提供有力支撑。对此,世卫组织总干事陈冯富珍博士表示“中国疫苗生产潜力巨大,我们希望能够看到越来越多的中国疫苗产品通过世界卫生组织的预认证,全世界都会因此而受益”。
2011年3月WHO宣布我国国家药品监管机构通过了世界卫生组织疫苗监管体系的评估,从此,中国的疫苗生产企业具备了申请世界卫生组织疫苗预认证的资格,打开了中国疫苗产品进入国际市场的大门。近年来,随着食品药品监管部门通过推行新修订药品GMP(2010版)等多项措施,不断提高生产标准和监管水平,我国药品生产企业整体水平迅速提高,为中国疫苗产品获得国际认可创造了条件。
中国药品生产企业为全世界提供安全有效的疫苗产品是中国履行国际责任和义务的体现。国家食品药品监督管理总局将继续提高监管能力、加强各项监管措施,鼓励、支持和引导企业研制、生产向国际标准看齐,通过WHO预认证这个平台,努力让更多符合国际标准的高质量药品进入国际市场,并以此为契机,促进我国药品产业的全面升级和药品质量水平的全面提升。
乙型脑炎是一种由蚊子叮咬传播的疾病,会导致大脑炎症,其地域性季节性的流行属于世界性重大公共卫生问题。由于目前没有针对乙脑的专门治疗手段,注射疫苗是一项有效预防措施。
2013-08-21
新加坡和中国科学家合作开发出对抗登革热的新疫苗。如果临床试验获得成功,它将成为首个可同时预防登革热所有四种常见亚型的疫苗。
这一研究由新加坡科技研究局下属的新加坡免疫学组、新加坡诺华热带疾病研究所和中国军事医学科学院微生物流行病研究所合作完成。
新加坡科技研究局13日说,研究人员使用了新策略,削弱登革热病毒躲避宿主免疫系统的能力,弱化后的登革热病毒有望成为一种安全有效的疫苗。
登革热病毒进入人体后,会发生基因改变,从而躲过免疫系统的侦测。促使基因发生改变的关键是一种特定的甲基转移酶,研究人员引入基因突变使这种酶失效,免疫系统就能够有效发现登革热病毒的存在,产生对应的抗体。
动物实验证实,经上述基因改造进行弱化的登革热病毒能使动物获得抵抗力,免受正常登革热病毒的侵害。研究人员还发现,弱化后的病毒不会感染伊蚊,意味着它们不会在伊蚊体内复制,也不会通过蚊子影响到自然环境。
登革热属于最常见的由蚊子叮咬传播的疾病之一。它主要由伊蚊传播,一般按病毒类型分为四种最常见的亚型,新加坡最近爆发的登革热疫情包括全部四种类型。
目前尚无有效抵抗登革热的疫苗。新加坡科技研究局团队的下一步计划是研究疫苗配方,通过一次注射同时预防四种亚型的登革热。如果该策略在人身上得到验证,将是登革热疫苗领域的一项重大突破。
这一研究由新加坡科技研究局下属的新加坡免疫学组、新加坡诺华热带疾病研究所和中国军事医学科学院微生物流行病研究所合作完成。
新加坡科技研究局13日说,研究人员使用了新策略,削弱登革热病毒躲避宿主免疫系统的能力,弱化后的登革热病毒有望成为一种安全有效的疫苗。
登革热病毒进入人体后,会发生基因改变,从而躲过免疫系统的侦测。促使基因发生改变的关键是一种特定的甲基转移酶,研究人员引入基因突变使这种酶失效,免疫系统就能够有效发现登革热病毒的存在,产生对应的抗体。
动物实验证实,经上述基因改造进行弱化的登革热病毒能使动物获得抵抗力,免受正常登革热病毒的侵害。研究人员还发现,弱化后的病毒不会感染伊蚊,意味着它们不会在伊蚊体内复制,也不会通过蚊子影响到自然环境。
登革热属于最常见的由蚊子叮咬传播的疾病之一。它主要由伊蚊传播,一般按病毒类型分为四种最常见的亚型,新加坡最近爆发的登革热疫情包括全部四种类型。
目前尚无有效抵抗登革热的疫苗。新加坡科技研究局团队的下一步计划是研究疫苗配方,通过一次注射同时预防四种亚型的登革热。如果该策略在人身上得到验证,将是登革热疫苗领域的一项重大突破。
2013-08-08
国家食品药品监督管理总局批准国产盐酸美金刚原料药和制剂新药上市
近期,国家食品药品监督管理总局批准国产盐酸美金刚溶液和盐酸美金刚片用于中重度至重度阿尔茨海默型痴呆的治疗。
阿尔茨海默型痴呆(Alzheimer disease,以下简称AD),是一种中枢神经系统退行性疾病,是老年期痴呆最常见的一种类型。起病隐袭,病程呈慢性进行性,发病率随年龄增加而增高。临床表现为认知能力下降、精神行为异常、日常生活能力降低等。研究发现,AD发病机制与中枢胆碱能损伤和兴奋性氨基酸毒性有关。目前,国内外批准用于阿尔茨海默病治疗的药物主要有胆碱酯酶抑制剂和谷氨酸受体拮抗剂两类。
国家食品药品监督管理总局已批准用于治疗AD的药物主要是胆碱酯酶抑制剂。包括盐酸多奈哌齐片、石杉碱甲胶囊、氢溴酸加兰他敏片、重酒石酸卡巴拉汀胶囊等。盐酸美金刚是谷氨酸受体拮抗剂,可以阻断谷氨酸浓度病理性升高导致的神经元损伤,主要用于中重度AD患者。由于作用机制不同,盐酸美金刚可与胆碱酯酶抑制剂合用,增加疗效。
盐酸美金刚目前已在德国、美国等国家上市。我国于2006年9月批准国外制药公司的盐酸美金刚片进口。此次国家食品药品监督管理总局批准的珠海联邦制药股份有限公司生产的盐酸美金刚口服溶液(120ml:240mg)是3.1类新药,盐酸美金刚片(10mg)是国内首家盐酸美金刚仿制药,均经生物等效性试验证明与参比制剂具有生物等效性。同时还批准了该公司的原料药新药生产,实现了从原料药到制剂的国产化。
国家食品药品监督管理总局批准盐酸美金刚的说明书,包括使用说明和服用该药物的潜在风险信息。对于中重度肾功能不全患者,美金刚应减量。对于癫痫患者、有惊厥病史、或癫痫乙肝体质患者使用美金刚时应慎重。妊娠期不应服用,哺乳期服用应停止哺乳。
阿尔茨海默型痴呆(Alzheimer disease,以下简称AD),是一种中枢神经系统退行性疾病,是老年期痴呆最常见的一种类型。起病隐袭,病程呈慢性进行性,发病率随年龄增加而增高。临床表现为认知能力下降、精神行为异常、日常生活能力降低等。研究发现,AD发病机制与中枢胆碱能损伤和兴奋性氨基酸毒性有关。目前,国内外批准用于阿尔茨海默病治疗的药物主要有胆碱酯酶抑制剂和谷氨酸受体拮抗剂两类。
国家食品药品监督管理总局已批准用于治疗AD的药物主要是胆碱酯酶抑制剂。包括盐酸多奈哌齐片、石杉碱甲胶囊、氢溴酸加兰他敏片、重酒石酸卡巴拉汀胶囊等。盐酸美金刚是谷氨酸受体拮抗剂,可以阻断谷氨酸浓度病理性升高导致的神经元损伤,主要用于中重度AD患者。由于作用机制不同,盐酸美金刚可与胆碱酯酶抑制剂合用,增加疗效。
盐酸美金刚目前已在德国、美国等国家上市。我国于2006年9月批准国外制药公司的盐酸美金刚片进口。此次国家食品药品监督管理总局批准的珠海联邦制药股份有限公司生产的盐酸美金刚口服溶液(120ml:240mg)是3.1类新药,盐酸美金刚片(10mg)是国内首家盐酸美金刚仿制药,均经生物等效性试验证明与参比制剂具有生物等效性。同时还批准了该公司的原料药新药生产,实现了从原料药到制剂的国产化。
国家食品药品监督管理总局批准盐酸美金刚的说明书,包括使用说明和服用该药物的潜在风险信息。对于中重度肾功能不全患者,美金刚应减量。对于癫痫患者、有惊厥病史、或癫痫乙肝体质患者使用美金刚时应慎重。妊娠期不应服用,哺乳期服用应停止哺乳。
| 页码:1/19 |